
Engenheiros estão constantemente tentando aprimorar máquinas, materiais e tecnologias usadas no nosso dia-a-dia. É possível fazer testes e comparar algum indicador de performance de uma tecnologia padrão com uma tecnologia nova e assim, por tentativa e erro, levar a ciência e a humanidade a novos patamares.
Entretanto, muitas vezes, uma tecnologia pode ser analisada individualmente em suas partes (pense, por exemplo, em células a combustível ou eletrolisadores PEM, que possuem membrana, camada catalítica, camada difusora, entre outros componentes).
O mesmo é válido para processos químicos como um todo. Um exemplo clássico são os processos de Cogeração de Calor e Potência (CHP), que possuem etapas bem distintas e nos quais, em essência, calor é extraído de uma fonte quente, usada para realizar trabalho e rejeitada a uma temperatura mais baixa.
A termodinâmica é não apenas uma teoria física, mas também uma poderosa ferramenta prática para a análise e resolução de problemas de engenharia.
O conceito de exergia permite ao engenheiro calcular o quão eficiente um processo pode ser, sem precisar conhecer os detalhes do mesmo. Ao mesmo tempo, possibilita analisar as etapas do processo e discriminar quais são as mais ineficientes e onde há maior potencial de melhoria.
Com isso, o engenheiro é capaz de economizar tempo e dinheiro ao apontar o que é relevante e o que não é.
Tabela de Conteúdo
Exergia, trabalho potencial máximo, estado morto
Na termodinâmica, o trabalho realizado durante um processo depende do estado inicial, do estado final, e do caminho do processo. Ou seja, trabalho = f(estado inicial, estado final, caminho do processo).
O trabalho que pode ser produzido é maximizado (ou o trabalho a ser consumido minimizado) quando o processo entre dois estados especificados é realizado de modo reversível, ou seja, qualquer irreversibilidade é desprezada quando na determinação do trabalho potencial máximo.
Além disso, para que o trabalho máximo seja atingido, o sistema deve estar no estado morto ao fim do processo.
Estado morto é um estado em que o sistema está em equilíbrio termodinâmico com o ambiente que o envolve. Isto significa, na prática, que o sistema está em equilíbrio mecânico (pressão igual à pressão do ambiente) e equilíbrio térmico (temperatura igual à temperatura do ambiente).
Quando estamos falando sobre exergia, geralmente a temperatura e pressão do ambiente são denotadas com o subescrito 0, como em T_0.
Portanto:
Um sistema produz o máximo trabalho possível quando sofre um processo reversível do estado inicial especificado ao estado do seu ambiente, ou seja, o estado morto.
Isso representa o potencial de trabalho útil e é chamado exergia. De outro modo, representa o limite superior de quantidade de trabalho que um sistema pode desenvolver sem violar leis termodinâmicas.
Repare que exergia é uma propriedade conjunta de sistema-ambiente, e não apenas do sistema. Qualquer alteração do ambiente altera a exergia.
Além disso, um sistema pode ter, por exemplo, 10 unidades de energia. Isto não implica que sua exergia vale 10 unidades de energia, e sim que a exergia mais a energia indisponível valem juntas 10 unidades de energia.
Trabalho Útil, trabalho reversível e Irreversibilidade
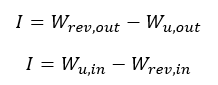
Qual fórmula é aplicada depende se o processo gera trabalho ou consome.
Eficiência de segunda lei

Uma definição mais geral de eficiência de segunda lei, mais apropriada para dispositivos que não são projetados para gerar ou consumir trabalho pode ser dada por:
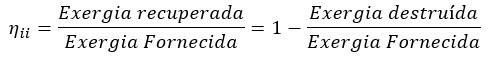
Para uma máquina térmica, a exergia fornecida é a diminuição na exergia do calor transferido para a máquina, que é a diferença entre a exergia do calor fornecido e a exergia do calor rejeitado (perceba que a exergia do calor rejeitado a temperatura do ambiente à sua volta é zero, por definição). O trabalho líquido produzido é a exergia recuperada.
Para um trocador de calor, com duas correntes que não se misturam, a exergia fornecida é a diminuição na exergia da corrente de maior temperatura, e a exergia recuperada é o aumento na exergia da corrente de menor temperatura.
Exergia e variação de exergia de sistemas abertos e fechados
A exergia de um sistema fechado e a sua variação, em base mássica, são dadas por:
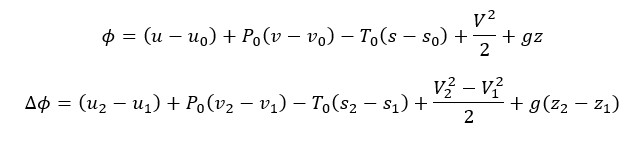
Onde v é o volume específico e V é a velocidade do sistema relativo à algum referencial inercial.
A exergia de um sistema aberto e a sua variação, em base mássica, são dadas por:
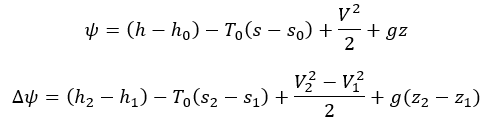
A variação de exergia de um sistema aberto ou fechado representa o máximo trabalho útil que pode ser produzido (ou o mínimo que necessita de ser fornecido) quando o sistema vai de um estado 1 para um estado 2 (em um ambiente especificado) e representa o trabalho reversível, W_rev.
A variação de exergia de um sistema é independente do tipo de processo ao qual está submetido.
Exergia destruída e balanço de exergia
A irreversibilidade de que tratamos logo acima também é chamada de exergia destruída, pois representa a perda de trabalho potencial, e é expressa como:
A exergia destruída é proporcional a entropia gerada, e, no melhor caso (reversível), vale 0.
É importante falar aqui que, devido à segunda lei da termodinâmica, a variação de exergia de um sistema que sofre um determinado processo não é a exergia destruída;
pelo contrário, a variação de exergia de um sistema é menor que a transferência (líquida) de exergia – entradas menos saídas – na mesma quantia da exergia destruída, ou seja:
Este é o balanço de exergia, e pode ser definido como:
A variação de exergia de um sistema durante um processo é igual a diferença entre a transferência de exergia líquida através da superfície do volume de controle e a exergia destruída dentro do volume de controle devido a irreversibilidades.
Conclusão
Espero ter ajudado a elucidar o conceito de exergia, que pode ser muito confuso por sua própria natureza, e que possa te servir de ferramenta quando precisar estimar a eficiência de um processo químico. Boa sorte e até a próxima!