
Diferença de potencial, força motriz, equilíbrio; estes conceitos aparecem em praticamente todos os campos da física. Na termodinâmica, com o equilíbrio de fases, não é diferente. Para uma boa formação em engenharia química é necessário ser capaz de visualizar e explicar esse fenômeno e seus conceitos abstratos.
Na engenharia química, uma aplicação imediata do equilíbrio de fases se encontra no dimensionamento de equipamentos voltados a processos de separação, como destilação, absorção, dessorção, adsorção, extração líquido-líquido, flash, separação por membranas, sublimação…enfim! São incontáveis possibilidades.
Mas afinal, o que é equilíbrio de fases?
Com esta série de artigos, pretendo contar uma história do equilíbrio de fases com início, meio e fim; desde os princípios teóricos que o fundamentam até a forma como isso impacta na prática coisas como equipamentos de separação.
Veremos:
- O conceito de Equilíbrio e a equação fundamental da termodinâmica;
- Potencial químico, fugacidade, e equilíbrio de fases;
- Coeficientes de fugacidade e de atividade;
- Modelos termodinâmicos e métodos de approach para gases e líquidos;
- Aplicação dos conceitos para Operações Unitárias.
O Conceito de Equilíbrio na Termodinâmica
Veja a seguinte imagem:
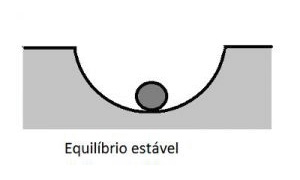
Se a bolinha for abandonada em qualquer inclinação, ela tende ao fundo da rampa. Neste exemplo estão presentes os conceitos de diferença de potencial, força motriz e uma forma de equilíbrio.
A diferença de altura entre o ponto de abandono da bolinha e o ponto mais fundo é a nossa diferença de potencial, ou ainda força motriz, que é aquilo que provoca o movimento rumo ao equilíbrio.
O equilíbrio é um estado no qual a força motriz para o movimento desaparece e o movimento cessa.
Além disso, podemos explorar uma outra propriedade do conceito de equilíbrio, muito usada em termodinâmica: um corpo em equilíbrio, quando deslocado deste equilíbrio de modo infinitesimal em uma direção, pode retornar ao estado inicial se deslocarmos o corpo também de maneira infinitesimal na outra direção.
Isso é o que se entende por um processo reversível.
No caso da bolinha, se ela for provocada já estando no centro, ela tende à voltar ao centro. Para exemplificar o que seria o processo irreversível, podemos supor que provocamos o movimento infinitesimal de uma bolinha que estivesse em equilíbrio na rampa inclinada.
Esta bolinha não poderia retornar ao estado de equilíbrio anterior simplesmente provocando o mesmo movimento infinitesimal no sentido contrário, já que ela está na rampa inclinada.
Equação Fundamental da Termodinâmica
Todo corpo, toda porção de massa no universo, contém energia (Na realidade, matéria e energia são conversíveis, mas vamos simplificar, né?). Esta energia armazenada dentro de um sistema pode ser chamada de energia interna, e é a soma da contribuição das energias químicas, nucleares e vibracionais dos átomos que o constituem.
Entretanto, a energia total do universo se conserva; esta é a Primeira Lei da Termodinâmica. Se o conteúdo energético de um sistema, isto é, sua energia interna, aumentar, é necessário que outro sistema diminua sua energia interna e transfira essa diferença para o primeiro.
As formas como a energia pode entrar e sair de um sistema são: calor, trabalho e variação na própria massa do sistema (Estão sendo desconsideradas aqui formas de energia que dependem da ação de algum campo, como o gravitacional, o centrífugo ou o elétrico, etc., que em geral não são de interesse do engenheiro químico ou, quando o são, podem ser tratados por outras abordagens).
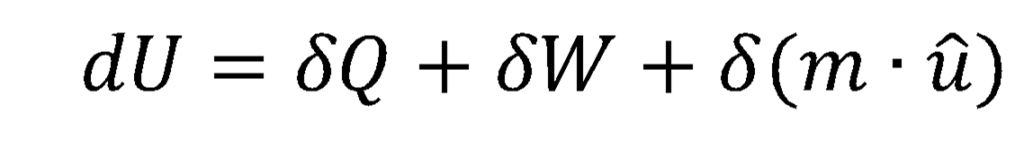
Na equação acima, d(m*û) é o conteúdo energético adicionado ou removido devido à entrada ou saída de massa; m é a massa total, e chamo de û uma certa energia específica por unidade de massa que, como veremos no próximo post, é o potencial químico.
Partindo do conhecido fato de que, numa modificação reversível da energia interna de um sistema aberto – ou seja, pode trocar calor, trabalho e massa com as vizinhanças – podemos substituir as duas primeiras parcelas por
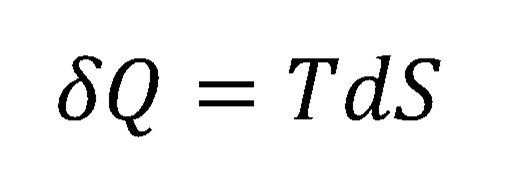
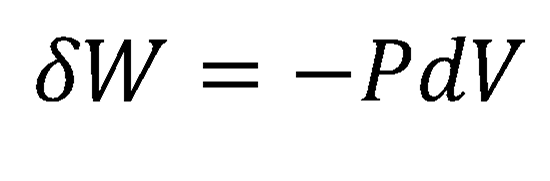
De modo que obteremos por fim uma expressão para a chamada Equação Fundamental da Termodinâmica:
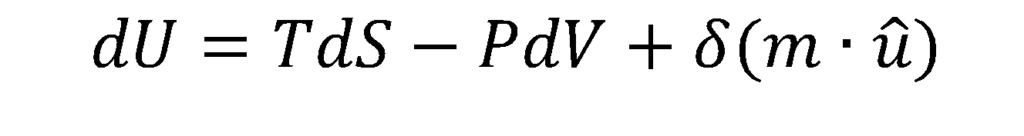
Conclusão
Foi apresentado neste artigo uma noção simples porém prática do que é equilíbrio no contexto da termodinâmica e desenvolvemos intuitivamente uma forma da equação geral da termodinâmica.
No próximo artigo, ficará mais claro qual é a aplicação da noção de equilíbrio e da equação geral quando discutirmos o que é potencial químico no equilíbrio de fases.
Até a próxima!