
A produção de hidrogênio verde tem ganhado destaque como uma das soluções mais promissoras para a transição energética global. Por ser produzido a partir de fontes renováveis, como energia solar e eólica, e utilizando apenas água como insumo, o hidrogênio verde apresenta o potencial de descarbonizar setores industriais inteiros, como o transporte, a siderurgia e a geração de energia. No entanto, apesar de suas vantagens ambientais, o custo elevado e os desafios tecnológicos associados à produção desse combustível ainda limitam sua ampla adoção.
É aqui que entra a modelagem de eletrolisadores — dispositivos responsáveis por dividir a água em hidrogênio e oxigênio usando energia elétrica. Por meio de modelos matemáticos e simulações computacionais, é possível otimizar o design e a operação desses equipamentos, maximizando a eficiência, reduzindo perdas e aproximando o hidrogênio verde da competitividade econômica em relação a combustíveis fósseis.
Neste post, exploraremos como a modelagem de eletrolisadores funciona, quais os principais desafios dessa abordagem e como ela pode impulsionar o avanço tecnológico na produção de hidrogênio verde. Prepare-se para mergulhar em um tema que combina engenharia de processos, sustentabilidade e inovação tecnológica!
Tabela de Conteúdo
Eletrolisador Alcalino (AWE)
Princípio de funcionamento
Na eletrólise alcalina da água, dois eletrodos promovem as semirreações de oxirredução da água a oxigênio e hidrogênio.
Uma solução aquosa de KOH ou NaOH (20 ~ 30 %m/m) é utilizada como eletrólito, e separa o anodo do catodo. As semirreações são:
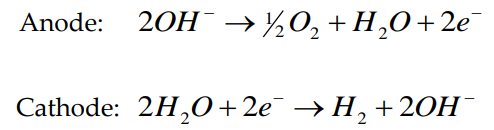
Ou seja, na eletrólise alcalina, a espécie oxidada no anodo é o íon hidroxila, enquanto que a espécie reduzida no catodo é a água.
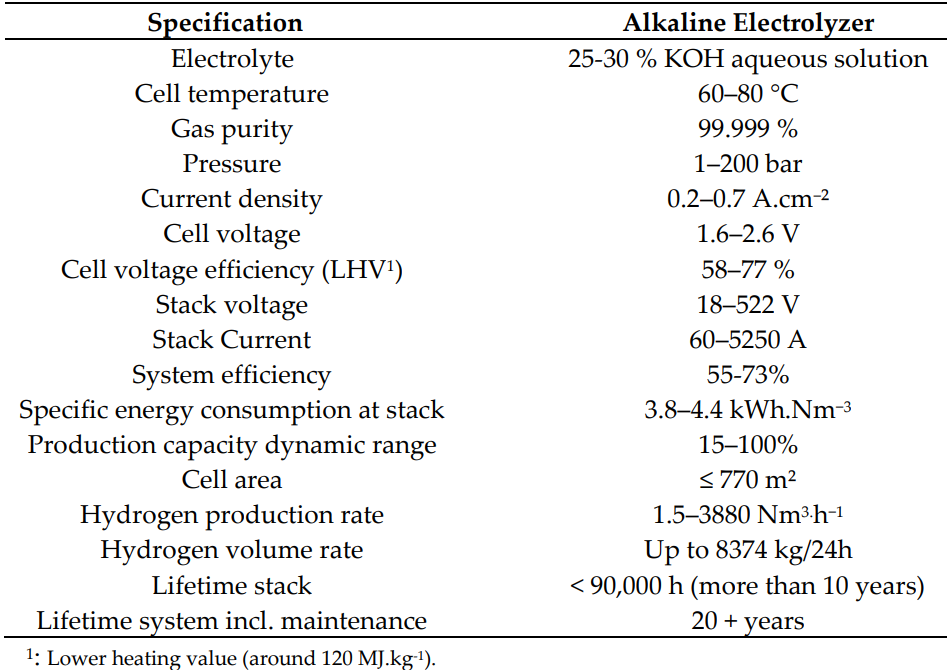
Parâmetros típicos para eletrolisadores alcalinos estão sumarizados abaixo [1].
Modelagem estática da termodinâmica eletroquímica
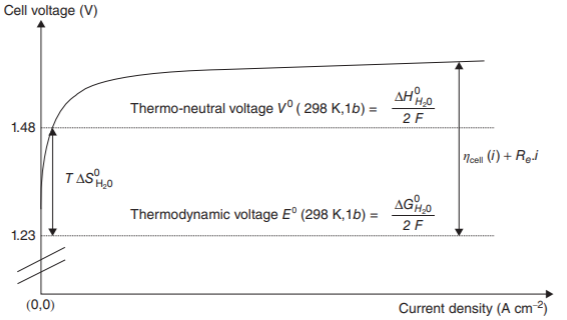
Quando a densidade de corrente é zero, o potencial elétrico que se lê é chamado de potencial termodinâmico, potencial reversível, ou potencial de circuito aberto (OC – Open Circuit). Este valor é o potencial eletroquímico que vêm da Equação de Nerst, e que, para a equação de oxirredução apresentada anteriormente, vale 1.23 V para condições normais.
Outro potencial citado na literatura é o potencial termoneutro [2]. Ele possui este nome devido ao fato da reação de eletrólise da água ser endotérmica e, portanto, exigir um fornecimento de calor para que o sistema não resfrie ao longo da operação da produção de hidrogênio.
Para a eletrólise da água, em condições normais de temperatura e pressão, o potencial termoneutro é de 1.48 V.
Na prática, o eletrolisador alcalino necessita de um sistema de resfriamento, pois outras perdas energéticas, citadas a seguir, fazem o potencial aplicado superar o potencial termoneutro, aquecendo-o, portanto.
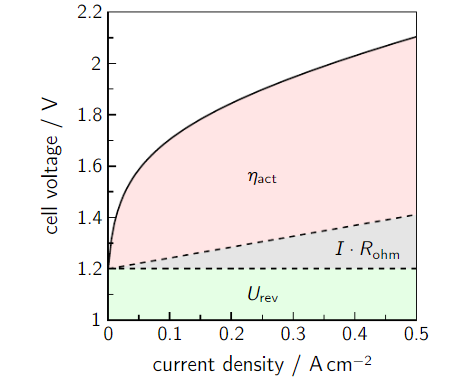
O potencial de uma célula eletrolítica depende essencialmente do potencial termodinâmico e dos chamados sobrepotenciais, isto é, acréscimos de tensão à tensão de circuito aberto necessários para polarizar os eletrodos (tirar do equilíbrio) ou para compensar perdas elétricas que ocorrem no circuito como um todo (perdas ôhmicas). Assim, a modelagem básica de uma célula eletrolítica consta dos seguintes termos:
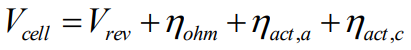
A letra grega eta representa tipicamente sobrepotenciais; aqui, sobrepotenciais ôhmicos e sobrepotenciais de ativação do anodo e do catodo.
O modelo semi-empírico comumente utilizado para construir a curva de polarização de um eletrolisador é a de Ullerberg, cuja forma é:
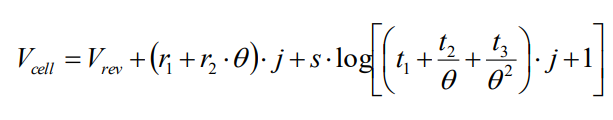
Unidades:
- Theta: temperatura de operação, em °C;
- r1 (Ω m2) e
- r2 (Ω m2 °C-1); refletem perdas ôhmicas;
- t1 (m2 A-1) e
- t2 (m2 A-1 °C) and t3 (m2 A-1 °C2) relacionados à polarização dos eletrodos por ativação; e
- j (A m-2) é a densidade de corrente.
| r1 | 8.05E-05 |
| r2 | -2.50E-07 |
| s | 0.185 |
| t1 | 1.002 |
| t2 | 8.424 |
| t3 | 247.3 |
Importante destacar, por último, que, tipicamente, um stack é um conjunto de células eletrolíticas ordenadas em série, de modo que a queda de tensão do stack é calculada por:
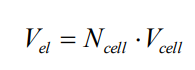
N representa o número de células (anodo + catodo) associadas em série, e V_el é a ddp desenvolvida por um stack do eletrolisador alcalino.
Exemplo
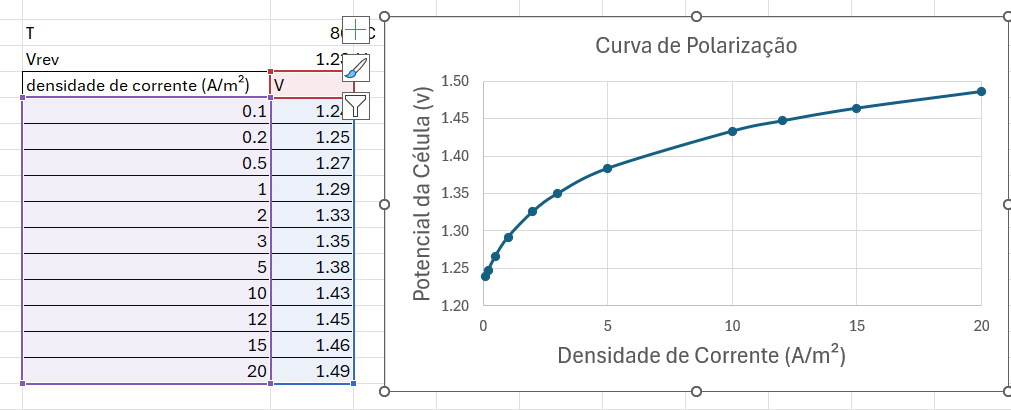
Lembrando que esta curva de polarização se refere apenas a uma célula de eletrólise, e não ao stack, e muito menos ao eletrolisador completo (considerando o Balanço de Planta – BoP – isto é, sistema de resfriamento, bombeamento e controle próprios do eletrolisador).
Conclusão
Neste post vimos o fundamento termodinâmico e eletroquímico da modelagem de eletrolisadores alcalinos para a produção de hidrogênio verde, além de deixar claro a diferença entre potencial termodinâmico, termoneutro, sobrepotencial de ativação, sobrepotencial ôhmico, e também entre a queda de tensão de uma célula, um stack e um eletrolisador completo (considerando o balanço de planta).
Também foi verificada a validade de um modelo semi-empírico aplicando-o, com parâmetros reais, em uma planilha Excel.
Se quiser aprimorar suas habilidades como projetista, compre aqui a nossa planilha de estimativa de custos para equipamentos de processos químicos. Até mais!